Дополнительная информация к главе 3 ‘Термодинамические свойства веществ‘ книги ‘Осмысление энтропии в свете свечи‘
Развитие термометрии в 18-ом веке привело к отделению понятия температуры от теплоты. К характеристикам вещества было добавлено новое свойство — теплоемкость, а для измерения количества теплоты были созданы калориметры (ледяной калориметр Лавуазье и Лапласа, 1780 год, см. ‘Теплота и калориметрия‘). Таким образом, к термическому уравнению состояния вещества потребовалось добавить калорическое для характеристики изменений, связанных с теплотой. Ниже будет дано описание опытов Гей-Люссака и Джоуля-Томсона, которые сыграли большую роль в этом процессе, а после этого результаты этих опытов будут рассмотрены с точки зрения классической термодинамики.
Успех калориметрии привел к укреплению позиций теории теплорода (теплота как функция состояния) и в первой половине 19-ого века большинство ученых были ее сторонниками. Серьезные проблемы для теории теплорода создавали опыты по быстрому сжатию и расширению газов, которые демонстрировали изменение температуры газов в этих процессах. Например, в 1803 году появилось воздушное огниво. Быстрое вдавливание поршня в трубке приводило к нагреву воздуха до температуры воспламенения трута, прикрепленного к поршню. Для объяснения этих явлений сторонники теории теплорода выдвинули гипотезу о зависимости теплоемкости газа от объема.
В 1807 году Гей-Люссак провел опыт по свободному расширению газа; схема опыта показана на рисунке ниже (рисунок взят из Thermopedia):
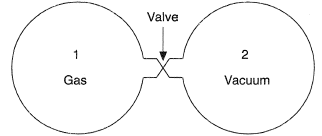
Два сосуда были соединены трубкой с краном. В одном сосуде находился газ, а в другом газ откачивался. В каждом сосуде находился термометр, который позволял следить за изменением температуры газа после открытия крана. Гей-Люссак установил, что температура газа в исходном сосуде после процесса расширения несколько понижалась, а температура газа в сосуде, куда входил газ, несколько повышалась по сравнению с исходной температурой. Тем не менее, общий эффект был нулевой — понижение температуры в одном сосуде было практически равно повышению температуры в другом сосуде.
Результаты эксперимента Гей-Люссака оказались в противоречии с ожиданиями теории теплорода, поскольку они показывали независимость теплоемкости газа от объема. Однако это не привело к опровержению теории теплорода; подобно другим случаям в истории науки отличие результатов эксперимента от теоретических ожиданий привело к отнесению эксперимента в разряд казусов — чего только не бывает. В данном случае интересно отметить, что Лаплас и Пуассон на основе теории теплорода в 1816 году смогли объяснить отличие опытных значений скорости звука в газе от предсказаний при использовании сжимаемости газа из уравнения состояния газа. В те времена это было еще одним доказательством правильности теории теплорода.
Только в 1842 году Роберт Майер правильно интерпретировал результаты опыта Гей-Люссака — для расширения газа в пустоту не требуется затраты тепла. Далее Майер использовал это обстоятельство в ходе нахождения численного эквивалента между между значениями теплоты и работы; Майер опирался на ранее полученные значения теплоемкости газов при постоянном объеме и давлении.
Джеймс Джоуль в 1845 году провел опыт, аналогичный опыту Гей-Люссака Неясно, знал ли Джоуль о статье Гей-Люссака, но в любом случае он получил аналогичные результаты. Постановка опыта Джоуля отличалась лишь тем, что оба сосуда были помещены в общий калориметр, в котором не удалось зафиксировать изменения температуры при расширении газа. Использование двух калориметров, для каждого сосуда отдельно, показывало такие же изменения температур в сосудах, как у Гей-Люссака.
Приведу обсуждение обоих опытов на современном уровне описания. Теплота не является функцией состояния и поэтому калорическое уравнение состояния относят к внутренней энергии U(T, V) как функции температуры (T, ниже использована абсолютная шкала температур) и объема (V):
Первая производная есть теплоемкость при постоянном объеме, а опыты Джоуля и Гей-Люссака позволяют сделать вывод о второй производной — зависимости внутренней энергии от объема при постоянной температуре. Из обоих экспериментов следует, что изменение температуры при изменении объема в случае постоянства внутренней энергии равно нулю:
В термодинамике важно только начальное и конечное состояние, поэтому следует проигнорировать кинетические эффекты, приводящие к разнице температур в обоих сосудах на первом этапе. В этом смысле результат выше соответствует опыту Джоуля с общим калориметром для обоих сосудов, когда в конечном состоянии температура в обоих сосудах уравнивается. Использование операций с производными функции U(T, V) (инвертор и пермутер, см. ‘Термическое уравнение состояния и термические коэффициенты‘) позволяет выразить вторую производную через результат опытов Гей-Люссака и Джоуля:
Таким образом из опытов Гей-Люссака и Джоуля следует, что внутренняя энергия идеального газа не зависит от объема и является только функцией температуры U(T).
Тем не менее, за время, отделяющее опыт Гей-Люссака от опыта Джоуля, произошли изменения во взглядах на уравнение состояния газа. В начале 19-ого века считалось, что все газы подчиняются единому уравнению состояния. Термин уравнение состояния идеального газа появился только во второй половине 19-ого века, после появления надежных экспериментальных данных об отклонении в поведении газов от законов Бойля-Мариотта и Гей-Люссака. Также появление молекулярно-кинетической теории помогло понять, что уравнение состояния идеального газа соответствует случаю отсутствия сил взаимодействия между молекулами; наличие сил взаимодействия приводит к отличию в поведении реальных газов.
Это обстоятельство потребовало изменений во взглядах на зависимость внутренней энергии от объема при постоянной температуре. В начале 1850-х годов Джоуль и Уильям Томсон (впоследствии лорд Кельвин) придумали и провели новую серию более чувствительных экспериментов. В них измерялось изменение температуры при протекании потока газа через препятствие (дроссель), как показано на рисунке ниже (рисунок из Большой советской энциклопедии):
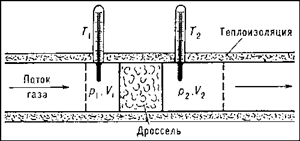
В данных условиях сохраняется энтальпия H = U + pV (про энтальпию см. также ‘Энтальпия и энергия Гиббса: математика и физика‘) и таким образом происходит измерение разности температур как функции разности давлений при постоянстве энтальпии (коэффициент Джоуля-Томсона).
Введение энтальпии H(T, p) как функции температуры и давления приводит к появлению двух производных:
Первая производная равна теплоемкости при постоянном давлении, вторая производная может быть выражена аналогичным образом через коэффициент Джоуля-Томсона:
Новые эксперименты показали, что действительно в данных условиях происходит изменение температуры и тем самым энтальпия реальных газов зависит от давления. В свою очередь это также означает, что внутренняя энергия реальных газов зависит от объема, поскольку одну производную можно пересчитать на другую.
После проведения новых экспериментов Джоуль оценил какое должно было бы быть изменение температуры в первом эксперименте, аналогичным опыту Гей-Люссака. Он признал, что это изменение температуры не было зафиксировано из-за слишком большой теплоемкости сосудов и жидкости калориметра. Это обстоятельство следует отнести к счастливым случайностям в развитии термодинамики, поскольку проведение расчетов в приближении идеального газа (внутренняя энергия не зависит от объема) существенно облегчает выкладки в расчетах по циклу Карно. Использование термического и калорического уравнений состояния реальных газов в этом случае привело бы к существенно более сложным расчетам.
В последней части заметки рассмотрим введение энтропии как новой функции состояния во втором законе. Оказывается, это не приводит к введению дополнительного уравнения состояния, требуемого для термодинамической характеристики вещества. Термическое и калорическое уравнение состояния полностью характеризует поведение чистого вещества в классической термодинамике. Более того, появление энтропии даже снимает необходимость проведения экспериментов Гей-Люссака или Джоуля-Томсона для определения калорического уравнения состояния.
Формально новая функция состояния S(T, V) приводит к появлению двух новых производных:
Однако подстановка этого уравнения в основное уравнение термодинамики dU = TdS — pdV дает связь этих производных с производными внутренней энергии по температуре и объему:
В классической термодинамике также доказывается соотношение Максвелла, которое выражает производную энтропии по объему через термическое уравнение состояния. Вывод не столь сложный, но я не буду его приводить:
Все вместе приводит к следующим выражениям для внутренней энергии U(T, V) и энтропии S(T, V):
Таким образом, для определения внутренней энергии и энтропии чистого вещества достаточно данных по теплоемкости и термического уравнения состояния; производная для опыта Гей-Люссака следует из этих данных. В случае производной в опыте Джоуля-Томсона появляются аналогичные выражения для энтальпии, которые позволяют рассчитать коэффициент Джоуля-Томсона из теплоемкости при постоянном давлении и термического уравнения состояния.
В заключение несколько слов про бесконечные жалобы с трудностями понимания энтропии как физической величины. Самое интересное, что такое можно увидеть периодически даже в учебниках термодинамики, когда говорится, что настоящее понимание энтропии достигается только в статистической термодинамики при переходе к уравнению Больцмана. Правда, даже в этом случае сам Ричард Фейнман отмечал, что ‘энтропия — довольно странная и трудная для понимания величина’ (Feynman lectures on computation).
В то же время основная проблема понимания последних уравнений связана с величиной теплоемкости при постоянном объеме (также теплоемкости при постоянном давлении при переходе к энтальпии). В случае с пониманием сущности CV в последних двух уравнениях, непонятно почему возникает отличие с пониманием внутренней энергии и энтропии, поскольку оба уравнения похоже по своей структуре и они обеспечивают связь внутренней энергии и энтропии с проводимыми экспериментальными исследованиями веществ. Если же возникают трудности с пониманием физической величины CV, то уравнение Больцмана в этом случае уже ничем не поможет.
Содержание: Термодинамика
Информация
И. Р. Кричевский, Понятие и основы термодинамики, 1970, глава IV, Адиабатические процессы.
J. S. Rowlinson, James Joule, William Thomson and the concept of a perfect gas. Notes and Records of the Royal Society 64, no. 1 (2010): 43-57.
Thomas RA. Rybolt, A virial treatment of the Joule and Joule-Thomson coefficients. Journal of Chemical Education 58, no. 8 (1981): 620.
