Содержание книги, книга в формате pdf
Ранее: Глава 3. Термодинамические свойства веществ
Идеализация Карно позволяет найти максимальный коэффициент полезного действия (к.п.д.) тепловой машины; в реальной тепловой машине к.п.д. меньше максимального. Этот факт приводит к появлению неравенства Клаузиуса, которое выражает это обстоятельство на языке энтропии. В классической термодинамике неравенство Клаузиуса задает критерий самопроизвольного процесса и одновременно критерий равновесия — состояния, которым завершается самопроизвольный процесс.
Мы начнем с рассмотрения неравенства Клаузиуса для изолированной системы и рассмотрим простейший пример тепловой смерти. Подстановка неравенства Клаузиуса в первый закон приводит к появлению основного неравенства термодинамики; также будет дан простой пример использования основного неравенства в случае достижения равновесия идеального газа. Эти простые примеры покажут, каким образом в классической термодинамике возможно рассмотрение неравновесных состояний.
В заключение случаи неравновесных состояний в рассмотренных примерах будут обобщены на более сложные неравновесные состояния. Также будет затронуто обстоятельство, которое я упоминал при рассмотрении температуры. Введение температуры требует само по себе условия достижение теплового равновесия, поэтому следует рассмотреть общий критерий равновесия на основе неравенства Клаузиуса в этом свете. Введение локального и глобального равновесия позволяет предложить концептуальное решение этой проблемы.
- Неравенство Клаузиуса для изолированной системы
- Простейший пример тепловой смерти
- Основное неравенство термодинамики
- Локальное и глобальное равновесие. Построение термодинамики
Неравенство Клаузиуса для изолированной системы
Неравенство во втором законе термодинамики (неравенство Клаузиуса) вызывает особые трудности при изучении классической термодинамики. Ниже я выпишу только часть второго закона, связанную с неравенством:
dS > dQ/Tex
Для простоты представим себе изолированную систему без обмена энергией с окружением — отсутствует теплообмен и не совершается работа. Это означает, что внутренняя энергия и объем остаются постоянными и таким образом неравенство Клаузиуса выглядит следующим образом:
(dS)U,V > 0
Нижние индексы подчеркивают условие постоянства внутренней энергии и объема, про это нельзя забывать. В этих условиях неравенство Клаузиуса становится критерием самопроизвольного процесса в изолированной системе — энтропия изолированной системы может только возрастать. Отсюда следует, что при достижении равновесия протекание самопроизвольного процесса прекращается, а энтропия достигает максимума при заданных значениях внутренней энергии и объеме.
В этот момент возникает определенная логическая проблема. Из утверждения о максимуме энтропии при достижении равновесия следует, что в классической термодинамике есть средства для работы с неравновесными состояниями. С другой стороны можно услышать, что равенство во втором законе можно использовать только для равновесных процессов — то есть, в классической термодинамике нельзя говорить об энтропии неравновесных состояний.
Этот вопрос упирается в многозначность термина неравновесное состояние. Мы начнем с простых примеров, в которых будет показано, что, как минимум, в классической термодинамике есть средства для работы с некоторыми неравновесными состояниями, а в последующем это утверждение будет обобщено на более сложные неравновесные состояния.
Простейший пример тепловой смерти
Начнем с простейшего примера, когда изолированная система состоит из двух подсистем, с одинаковой теплоемкостью (CV,1 = CV,2), не зависящей от температуры. Две подсистемы отделены друг от друга неподвижной перегородкой — индекс 0 характеризует начальные значения температур:
Объемы подсистем не меняются и единственная возможность изменений связана с температурами подсистем — перегородка пропускает теплоту. Примем, что переход внутренней энергии в виде теплоты происходит крайне медленно и что в обоих подсистемах не возникает градиентов температур. Другими словами, обе подсистемы находятся в состоянии локального равновесия с однородными температурами.
Полная система с другой стороны не находится в состоянии равновесия, поскольку возможен обмен энергией между подсистемами. Задачей становится рассмотрение всех возможных состояний полной системы. По условию задачи изменения внутренней энергии подсистем должны быть равны между собой с обратным знаком (полная энергия сохраняется: U = U1 + U2 = const), что в случае одинаковых теплоемкостей приводит к простому соотношению между температурами:
Переменная x показывает возможные изменения температур, повышение температуры в одной подсистеме равно понижению температуры в другой, поскольку теплоемкости одинаковы. Суммарная внутренняя энергия от x не зависит, поскольку постоянство суммарной внутренней энергии заложено в вывод последнего соотношения.
В то же время суммарная энтропия зависит от значений текущих температур в подсистемах, то есть, от значения x. В уравнении ниже взят интеграл энтропии при изменении температуры, а S0 обозначает суммарную энтропию в начальном состоянии:
Перед последним шагом рассмотрим график функции зависимости суммарной энтропии от x. Он построен для случая начальных температур 300 К и 400 К, при этом S0=0, CV=1.
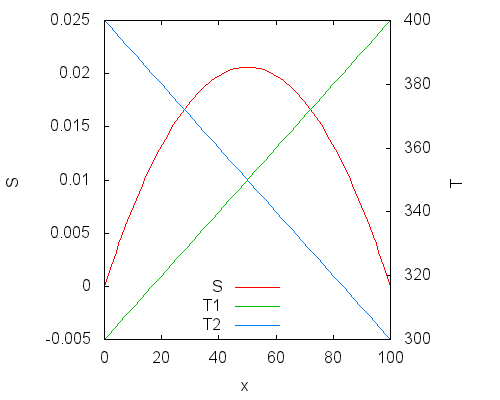
Изменение температуры показано на правой оси ординат: T1 = 300 + x, T2 = 400 ‐ x, изменение энтропии на левой. Энтропия достигает максимума при x = 50, когда температуры подсистем становятся равными. Это согласуется с ожиданиями — равновесное состояние всей системы соответствует термическому равновесию между подсистемами.
Максимум энтропии соответствует равенству нулю производной энтропии, это позволяет получить ответ в общем виде:
Итак, значение неравновесного состояния в этом примере связано со случаем, когда изолированная система состоит из подсистем, каждая из которых имеет однородные температуры. Подсистемы сами по себе находятся в равновесном состоянии, но они не находятся в равновесии друг с другом.
Важно отметить, что установление равновесия во всей системе является следствием второго закона термодинамики, поскольку изменение x на графике во всем интервале возможных значений не нарушает первый закон. Поэтому изменение энтропии в изолированной системе связывают со стрелой времени; как уже упоминалось, возрастание энтропии в изолированной системе задает направление самопроизвольных процессов.
На языке тепловых машин неравенство Клаузиуса выражает отсутствие полной эквивалентности работы и теплоты. Всю работу можно превратить в теплоту, но только часть теплоты можно превратить в работу. В изолированной системе, которая включает в себя тепловую машину и окружающие тела, самопроизвольные процессы приводят к потере возможности совершения работы. Полная энергия сохраняется, но при достижении полного равновесия в изолированной системе теряется возможность совершения работы.
Рассмотренный пример допускает пессимистическое истолкование в виде так называемой тепловой смерти вселенной. Рудольф Клаузиус после введения энтропии не упустил возможность перенести сказанное на всю вселенную: ‘Die Energie der Welt ist konstant. Die Entropie der Welt strebt einem Maximum zu. (Энергия мира постоянна, энтропия мира стремится к максимуму)’. Это классический пример экстраполяционизма, когда результаты исследования частного случая (тепловой машины) без промедления и колебаний переносятся на весь мир.
Основное неравенство термодинамики
При объединении неравенства Клаузиуса с первым законом получается основное неравенство классической термодинамики:
dU < TexdS ‐ pexdV
В неравенство входит внешняя температура и давление, которые фиксированы и поэтому уже не являются функциями энтропии и объема системы. Именно это обстоятельство приводит к тому, что основное неравенство существенно отличается по смыслу от основного уравнения термодинамики, рассмотренного в предыдущей главе. Основное уравнение описывает изменение термодинамических свойств вещества в пространстве независимых переменных, а основное неравенство является критерием самопроизвольности процесса в ходе достижения равновесия при заданных внешних условиях. Для лучшего понимания рассмотрим снова рисунок Сади Карно:
Представим следующую ситуацию. Вещество при однородных температуре и давлении (T1, p1) находилось в цилиндре. Далее цилиндр подключили к источнику теплоты с температурой Tex и изменили внешнее давление на pex. В этот момент начинается самопроизвольный процесс перехода вещества из начального состояния в конечное. Для его рассмотрения удобно перенести все слагаемые в левую часть неравенства:
dU ‐ TexdS + pexdV < 0
Это задает функцию, которая в самопроизвольном процессе может только уменьшаться и которая при достижении конечного равновесного состояния будет минимальна. Таким образом критерий самопроизвольного процесса одновременно является критерием достижения конечного равновесного состояния (минимальное значение функции в левой части неравенства).
В классической термодинамике в конечном равновесном состоянии всегда получаются однородные температура и давление — все градиенты исчезают. Поэтому я упрощу задачу и при рассмотрении неравенства выше я ограничу рассмотрение состояниями рабочего тела с однородными температурой и давлением. Задача станет такой — при рассмотрении всех возможных состояний рабочего тела с однородными температурами и давлениями найти равновесное состояние, которое соответствует заданным условиям.
Интуитивно ответ понятен, но давайте увидим формально, что неравенство выше согласуется с интуитивными ожиданиями — что его применение приводит к установлению термического и механического равновесия. Кстати, это демонстрирует относительность понятия равновесного состояния — состояние с однородной температурой и давлением может быть равновесным, но в данном рассмотрении оно является неравновесным по отношению к внешним условиям.
В рассматриваемой задаче при заданных ограничениях можно заменить dU в неравенстве на выражение из основного уравнения, поскольку оно применимо для описания изменений между состояниями с однородной температурой и давлением. Это дает следующее выражение
(T ‐ Tex)dS + (pex ‐ p)dV < 0
Теперь должно стать понятнее, что минимум функции слева будет достигаться при достижении рабочим телом температуры и давления, равным внешним давлению и температуры, то есть, неравенство в конечном итоге приведет к критерию термического и механического равновесия. Для наглядности сделаю ниже вычисление левой части в случае одного моля идеального газа: pV = RT (R — универсальная газовая постоянная). Для удобства переведу неравенство в пространство состояний температура — объем, поскольку в этих переменных получаются наиболее простые выражения для расчета. Для этого использую выражение энтропии как функцию от этих независимых переменных:
Первая часть уравнения относится к любому телу; CV — теплоемкость при постоянном объеме, которая ниже будет считаться независимой от температуры. Вторая часть уравнения получена вычислением производной по уравнению состояния идеального газа. Подстановка в неравенство плюс использование уравнения состояния идеального газа плюс выкладки приводит к выражению неравенства в случае одного моля идеального газа:
Поскольку переменные оказываются разделенными, можно взять интеграл при переходе из состояния (V1, T1) в (V2, T2), что дает конечное расчетное выражение:
В этом выражении (V1, T1) относятся к начальному состоянию в примере, (Vex, Tex) — к внешним условиям, (V2, T2) является промежуточным состоянием. Неравенство говорит, какие промежуточные состояния допустимы с точки зрения законов термодинамики при переходе из (V1, T1) в (Vex, Tex), а также в каком случае достигается минимум функции слева. Напомню, что минимальное значение функции будет соответствовать равновесному состоянию относительно заданных внешних условий (Vex, Tex). Ниже представлен контурный график для функции в левой части неравенства для двух фиксированных точек (V1, T1) и (Vex, Tex) как функция промежуточного состояния (V2, T2):
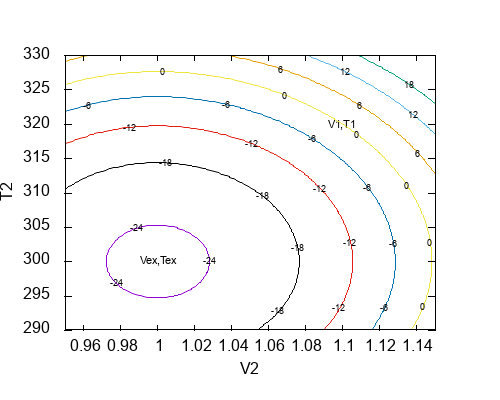
Как и следовало ожидать, функция достигает минимума в (Vex, Tex); это будет конечным равновесным состояниям. Положительные значения неравенства показывают, что в данных условиях самопроизвольный переход из (V1, T1) в эту область термодинамически невозможен. Рабочее тело может самопроизвольно переходить только в сторону уменьшения функции в левой части неравенства. В то же время неравенство не позволяет вычислить путь перехода, а также оно не содержит информации о времени перехода. Неравенство только позволяет классифицировать возможные состояния при переходе из (V1, T1) в (Vex, Tex) на термодинамически допустимые и термодинамически недопустимые, а также оно говорит, что минимальное значение соответствует равновесному состоянию.
Локальное и глобальное равновесие. Построение термодинамики
В двух рассмотренных примерах использовалась подсистема с однородной температурой и давлением. Неравновесное состояние получалось при контакте двух подсистем или контакте одной подсистемы с внешними условиями. Это показывает относительность понятия ‘равновесное состояние’ — подсистема может быть в равновесном состоянии сама по себе, а неравновесность вызывается контактами этой подсистемы с другими подсистемами или внешними условиями. В этом случае следует отличать локальное равновесие от глобального. Глобальное неравновесное состояние всей системы разбивается на подсистемы, каждая из которых находится в локальном равновесии. Далее подсистемы в локальном равновесии обмениваются энергией между собой и с внешними условиями до достижения полного равновесия между всеми подсистемами и внешними условиями. Такое состояние будет называться глобальным равновесием.
В рассмотренных примерах всю систему можно назвать прерывной — она состоит из подсистем, в каждой из которых температура однородна. Можно обобщить такое рассмотрение на случай одной системы с полем температур путем разбиения исходной системы на бесконечно малые подсистемы. Таким образом, в классической термодинамике вполне есть средства работы с неравновесными состояниями при использовании принципа локального равновесия.
Введение локального и глобального равновесия также решает одну из проблем в построении термодинамики. При рассмотрении понятия температуры обращалось внимание, что введение температуры уже требует допущения об установлении теплового равновесия между термометром и системой. Точно также при рассмотрении первого закона неявно использовалось допущение об установлении механического равновесия после движения поршня. Правда, последнее являлось естественной частью механики, в которую всегда закладывалось установление статического равновесия.
Следует сказать, что при построении термодинамики были использованы принципы локального равновесия, а неравенство Клаузиуса и основное неравенство термодинамики дает формулировку критериев глобального равновесия. При этом критерии глобального равновесия приводят к следствиям, которые невозможно вывести непосредственного из принципа локального равновесия без введения первого и второго закона. Например, использование критериев глобального равновесия в применении к химическим и фазовым равновесиям содержится в классической работе Гиббса ‘О равновесии гетерогенных веществ‘ 1876-1878 гг. Работа Гиббса лежит в основе обсуждения направление протекания химических реакций и тем самым она играет роль в понимании процесса горения свечи.
В то же время при обсуждении вопроса стрелы времени нельзя забывать, что установление теплового равновесия является пререквизитом классической термодинамики, а установление механического равновесия является пререквизитом механики сплошных сред. Таким образом, строго говоря, второй закон в классической термодинамике показывает направление установления глобального равновесия при условии существования локального равновесия.
В этом свете несколько слов про аксиоматизацию. Можно увидеть попытки упростить построение термодинамики исходя из принципа глобального равновесия. Вначале вводятся внутренняя энергия и энтропия, а затем температура определяется как производная внутренней энергии по энтропии: T = (∂U/∂S)V. Например, см. аксиоматизацию в статье Либа и Ингвасона 1999 года — Lieb&Yngvason ‘The physics and mathematics of the second law of thermodynamics‘.
С моей точки зрения такое построение термодинамики проблематично, поскольку непонятно, как в нем ввести в рассмотрение поле температур, а также поле давлений. Без этого в свою очередь становится непонятно, как можно использовать неравенство Клаузиуса, которое предполагает наличие определенных средств для работы с неравновесными состояниями. Мы вернемся к рассмотрению этих вопросов в последней главе 6 ‘Энтропия неравновесных состояний‘, где будет также рассмотрена связь между классической и неравновесной термодинамикой.
Далее: Глава 5. Адиабатическая температура пламени
Список литературы
Elliott H. Lieb and Jakob Yngvason. The physics and mathematics of the second law of thermodynamics. Physics Reports 310, no. 1 (1999): 1-96.
Приложение
Сценарий Gnuplot для построения рисунка в первом примере.
set terminal png enhanced size 500,400
set output 'fig1.png'
set xlabel 'x'
set ylabel 'S'
set y2label 'T'
set y2tics
set ytics nomirror
set key center bottom
plot [x=0:100] log((300+x)/300)+log((400-x)/400) title 'S', 300+x axis x1y2 title 'T1', 400-x axis x1y2 title 'T2'Сценарий Gnuplot для построения рисунка во втором примере.
set nokey
set terminal png enhanced size 500,400
set output 'inequality_map.png'
set style textbox noborder
set view map scale 1
set isosamples 200, 200
unset surface
set contour base
set cntrlabel format '%8.3g' font ',7' start 20 interval 50
set cntrparam levels incremental -24, 6, 18
set style data lines
R = 8.314
Vex = 1
Tex = 300
Cv = 2.5*R
V1 = 1.1
T1 = 320
fun(V2, T2) = Cv*(T2-T1)-Tex*Cv*log(T2/T1)+R*Tex/Vex*(V2-V1)-R*Tex*log(V2/V1)
set label "Vex,Tex" at Vex, Tex center font ',8'
set label "V1,T1" at V1, T1 center font ',8'
set xlabel "V2"
set xrange [ 0.95 : 1.15 ]
set ylabel "T2"
set yrange [ 290 : 330 ]
splot fun(x, y) with lines, fun(x, y) with labels boxedДополнительная информация
Неравенство Клаузиуса в философии и истории физики: Температура и температурное поле в физике 19-ого века. Простой пример установления теплового равновесия. Механика сплошных сред и неравенство Клаузиуса. Физика и математика в термодинамике.
Клиффорд Трусделл и классическая термодинамика: Обсуждение и критика позиции Трусделла в отношении классической термодинамики, поскольку неравенство Клаузиуса играет важную роль в классической термодинамики. Сравнение с термодинамикой Пуанкаре.
Обсуждение
